舒泰神
300204
- 市盈率(静): 205.07
- 市盈率(TTM): 186.93
- 市净率: 3.48
- 总股本: 4.76亿股
- 流通股本: 4.67亿股
- 总市值: 亿
- 流通市值: 亿
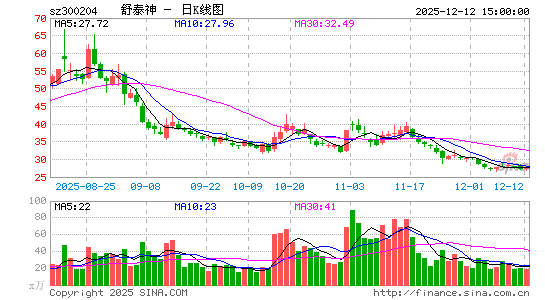
创新药概念股午后持续走低,热景生物、悦康药业跌超10%,立方制药、广生堂、塞力医疗、海思科、海特生物、振东制药、舒泰神等多股跌超5%。
08-25 18:22
舒泰神(300204.SZ)公告称,2025年上半年营业收入1.26亿元,同比下降31.14%。归属于上市公司股东的净亏损2463.56万元,上年同期净亏损342.3万元。
08-15 18:41
舒泰神(300204.SZ)公告称,公司持股5%以上股东香塘集团有限公司计划自本公告披露之日起15个交易日后的3个月内,以大宗交易和集中竞价方式分别减持公司股份不超过477.77万股,合计占公司总股本的2%。
创新药概念日内冲高后持续回落,高位股昂利康逼近跌停,南新制药、华森制药、悦康药业、辰欣药业、贵州百灵、舒泰神均跌超6%。
创新药概念股局部反弹,翰宇药业午后直线拉升涨超10%,海辰药业、阳光诺和、广生堂涨超10%,福源医药、万泽股份涨停,陇神戎发、京新药业、常山药业、舒泰神等跟涨。
07-29 09:45
化学制药板块短线拉升,辰欣药业涨停,丰原药业、宣泰医药、华纳药厂、舒泰神、兴齐眼药等跟涨。
创新药概念反复活跃,键凯科技涨超10%,南京新百2连板,联环药业、微芯生物、迪哲医药、舒泰神、凯莱英等跟涨。
05-29 19:17
舒泰神(300204.SZ)公告称,公司关注到近期市场对国家药品监督管理局药品审评中心网站信息公开栏目关于“拟优先审评品种公示”栏中公司控股子公司申请的“注射用STSP-0601”相关信息关注度较高;该药品正处于公示期内,后续是否进入优先审评程序仍存在诸多不确定性。
05-29 16:31
深交所披露,舒泰神5月20日至5月29日累计上涨108.7%,涨幅严重异常期间获自然人买入48.32亿元,占比65.17%;其中,中小投资者累计买入31.14亿元,占比41.99%。机构投资者累计买入25.83亿元,占比34.83%。
创新药概念再度走强,舒泰神涨超15%,股价创3年多新高,键凯科技、博瑞医药、健友股份、三生国健、益方生物等涨幅靠前。
创新药、CRO概念股再度走强,三生国健涨超10%,科兴制药、振东制药、海翔药业、百奥泰、富祥药业、昊帆生物涨超5%,舒泰神、金凯生科、凯莱英等跟涨。
创新药概念股持续走高,信立泰、科伦药业双双创历史新高,阳光诺和冲击20CM涨停,众生药业此前涨停,海辰药业、贝达药业、泓博医药涨超10%,舒泰神、海翔药业、泰格医药、华海药业等多股涨超5%。
05-22 19:14
舒泰神晚间公告,公司多个在研项目属于创新型生物制品。创新生物医药具有高科技、高风险、高附加值的特点,从研制、临床试验、报批到投产的周期长、环节多,容易受到技术、审批、政策等诸多因素影响,面临临床试验进度可能不如预期、临床试验结果可能不如预期、药品申请上市批准可能不如预期等诸多风险,请广大投资者谨慎决策,注意投资风险。
创新药概念反复走强,三生国健走出20CM4连板,海辰药业涨超10%,舒泰神、海翔药业、睿智医药、上海谊众等涨幅靠前。
05-13 19:48
舒泰神5月13日晚间公告,公司子公司贝捷泰于近期取得了江苏省药监局下发的药品生产许可证。药品名称:注射用 STSP-0601。
创新药概念集体回调,迈威生物跌超10%,百济神州、信立泰双双跌超8%,益方生物、舒泰神、热景生物、百利天恒、诺诚健华等跌幅靠前。
05-09 09:39
创新药概念股拉升,舒泰神涨超10%,海创药业涨超6%,热景生物、恒瑞医药、通化金马拉升。
05-08 16:44
舒泰神(300204)5月8日晚间公告,近日公司取得STSP-0902注射液用于治疗少弱精子症的Ia期临床研究总结报告:本试验结果支持STSP-0902注射液开展进一步的临床研究。
01-15 16:26
舒泰神(300204)1月15日晚间公告,预计2024年归属于上市公司股东的净利润亏损1.21亿元—1.48亿元,上年同期亏损3.99亿元。
08-02 09:42
舒泰神20CM涨停,香雪制药涨超10%,河化股份、双成药业涨停,金凯生科、博腾股份、昭衍新药、睿智医药、博济医药等跟涨。消息面上,国家药监局同意在北京上海开展优化创新药临床试验审评审批试点。